
-
中文 | EN

中文 | EN
发布时间:2024-07-08 00:00:00.0
在细胞的微观舞台上,蛋白质通过相分离现象自发组织成无膜细胞器,承担着细胞内结构的构建、信号传导的增强和基因表达的调控等关键的生物学功能。蛋白质相分离的异常与多种疾病的发生发展紧密相关,包括癌症、神经退行性疾病和传染病等。深入理解蛋白质相分离的机制,对于揭示细胞组织和功能的基本原理,阐释疾病的发病机制,以及新药物的开发具有重要的科学意义和应用价值。刘聪课题组胡姣姣博士近年一直专注于不同功能蛋白动态相分离机制及其在生理和病理过程中作用的研究。近期,其主导的研究工作成果相继发表在Chemical Science及Nucleic Acids Research上。
在Chemical Science上发表的题为“Hsp90α forms condensate engaging client proteins with RG motif repeats”的工作中,胡姣姣博士与合作者首次报道了经典分子伴侣蛋白Hsp90α的体外相分离现象,并阐释其动态组装的分子机制。研究利用高通量蛋白相分离表征技术(High-throughput protein phase separation, HiPPS)和LC-MS/MS的蛋白质组学分析,确定了分子拥挤剂以及带正电荷氨基酸多肽促进Hsp90α在体外发生相分离(图1)。通过对细胞裂解液中重构相分离液滴的蛋白质组学分析,发现其底物蛋白大部分归属于细胞中的无膜细胞器,且众多的底物蛋白含有多次重复的RG基序。进一步的机制研究表明,Hsp90α的相分离主要由其分布在NTD、MD以及CTD结构域表面的带负电氨基酸与底物蛋白上的带正电氨基酸之间的静电相互作用驱动。ALS/FTD中C9orf72基因突变产生的二肽重复包括GRn以及PRn能够促进Hsp90α的相分离,但会显著降低其液滴的流动性。总体而言,该研究首次揭示了Hsp90α的相分离现象并鉴定了凝聚体中的底物蛋白,为未来研究Hsp90α在各种MLOs中的功能奠定了开创性的基础。更为重要的是,该研究为由GRn以及PRn二肽重复引起的神经退行性疾病的病理机制提供了新的见解。
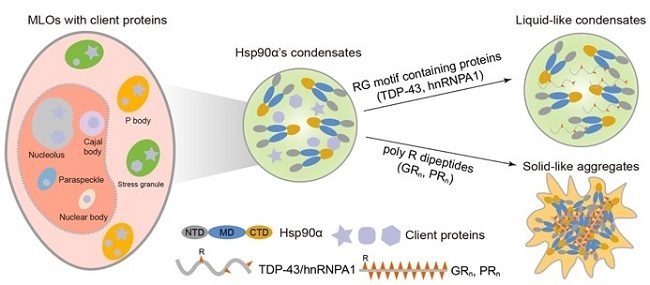
图1. Hsp90α体外相分离及底物蛋白对其相分离的调控。
在Nucleic Acids Research上发表的题为“Phase-separated ParB enforces diverse DNA compaction modes and stabilizes the parS-centered partition complex”的工作中,胡姣姣博士与上海科技大学生命学院孙博课题组合作,揭示了染色体分离蛋白ParB通过相分离凝聚DNA,形成多样化的分离复合物组装模式(图2)。研究利用荧光光镊和体外蛋白相分离表征技术,发现枯草芽孢杆菌ParB(Spo0J)蛋白具有与DNA共相分离的能力,压缩DNA并形成分离复合物。研究结果表明,ParB通过多聚体形式实现高阶复合物的组装并维持其稳定性,为细菌染色体分离的动态组装和维护提供了新的分子基础。
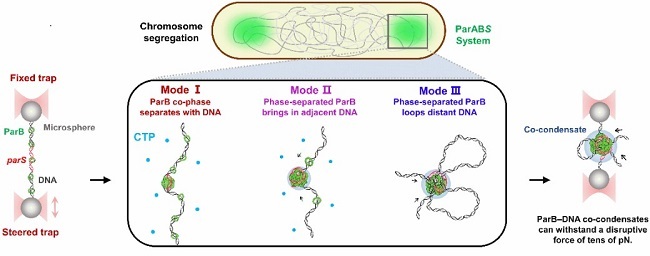
图2. ParB蛋白通过相分离驱动分离复合物组装的多种模式。
在Hsp90α工作中,交叉中心胡姣姣博士为第一作者及共同通讯作者,李丹教授和刘聪研究员为共同通讯作者。此外,北京大学李婷婷课题组以及交叉中心张耀阳课题组对Hsp90α工作提供了大力帮助。在ParB工作中,上科大生命学院研究生赵艺琳、郭丽娟及交叉中心胡姣姣博士为共同第一作者,孙博教授和刘聪研究员为共同通讯作者。以上工作受到国家自然科学基金、国家重点基础研究发展计划、上海市科学技术委员会、中国科学院上海分院等基金的资助。
论文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae533
https://pubs.rsc.org/en/content/articlelanding/2024/sc/d4sc00267a
